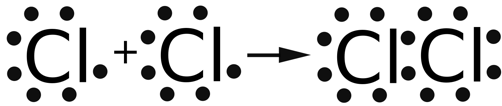Facit – Uppgifter kemi 1, block 1, del 1
1)
Se bilden:
2)
Bohr kom på idén med olika elektronskal när han studerade vätets linjespektrum. Vätets linjespektrum visar att en samling väteatomer kan avge totalt fyra olika våglängder i det synliga området (fyra olika färger) och att det alltid är samma våglängder/färger som sänds ut. För att avge dessa våglängder/färger måste dock först väteatomerna exciteras (uppta energi från omgivningen genom t.ex. värmeenergi eller UV-ljus).
Bohr menade att förklaringen till dessa färger är att vätets elektron bara kan befinna sig på vissa bestämda avstånd (energinivåer/elektronskal) från atomkärnan och aldrig däremellan (ungefär som trappstegen i en trappa).
Om energi tillförs utifrån (t.ex. värme, UV-ljus, elektricitet) så kan elektronen hoppa ut en eller flera energinivåer/elektronskal (excitation). Elektronen kommer dock snabbt falla tillbaka till grundnivån eftersom atomkärnan attraherar och drar tillbaka elektronen (deexcitation). När elektronen faller tillbaka sänder den ut den tidigare absorberande energin, bl.a. i form av ljus med olika våglängder/färger. Väteatomen sänder ut fyra olika färger eftersom elektronen kan hoppa/falla på fyra olika sätt som ger upphov till synligt ljus.
Om det inte finns olika energinivåer/elektronskal där vätets elektron kan befinna sig, och hoppa mellan, så går det inte att förklara vätets linjespektrum. Bohrs atommodell blev därför snabbt accepterad.
3)
Rutherford två av hans studenter att utföra ett experiment där ett radioaktivt ämne riktades mot en mycket tunn guldfolie. Det radioaktiva ämnet avgav radioaktiv strålning i form av positivt laddade alfa-partiklar (heliumkärnor). De flesta alfa-partiklarna passerade rakt igenom guldfolien, men några studsade tillbaka. Utifrån detta experiment drog Rutherford slutsatsen att det måste finnas en liten men kompakt positiv kärna i mitten av guldatomerna som innehåller det mesta av atomens massa (annars skulle inte alfa-partiklarna studsa tillbaka). Rutherford drog även slutsatsen att det mesta i atomen måste vara tomrum för annars hade inte de flesta alfa-partiklarna åkt rakt igenom atomerna. Han menade att de negativa elektronerna rör sig runt atomkärnan på mycket stora avstånd från atomkärnan och att de kretsar runt atomkärnan ungefär som planeterna kretsar runt solen.
4) Protoner, neutroner och elektroner.
5) Neutronerna avskärmar protonerna från varandra och därmed stabiliserar de atomkärnan. Om det enbart skulle vara protoner så skulle protonerna repellera varandra (stöta bort) p.g.a. den positiva laddningen.
6)
Natrium:

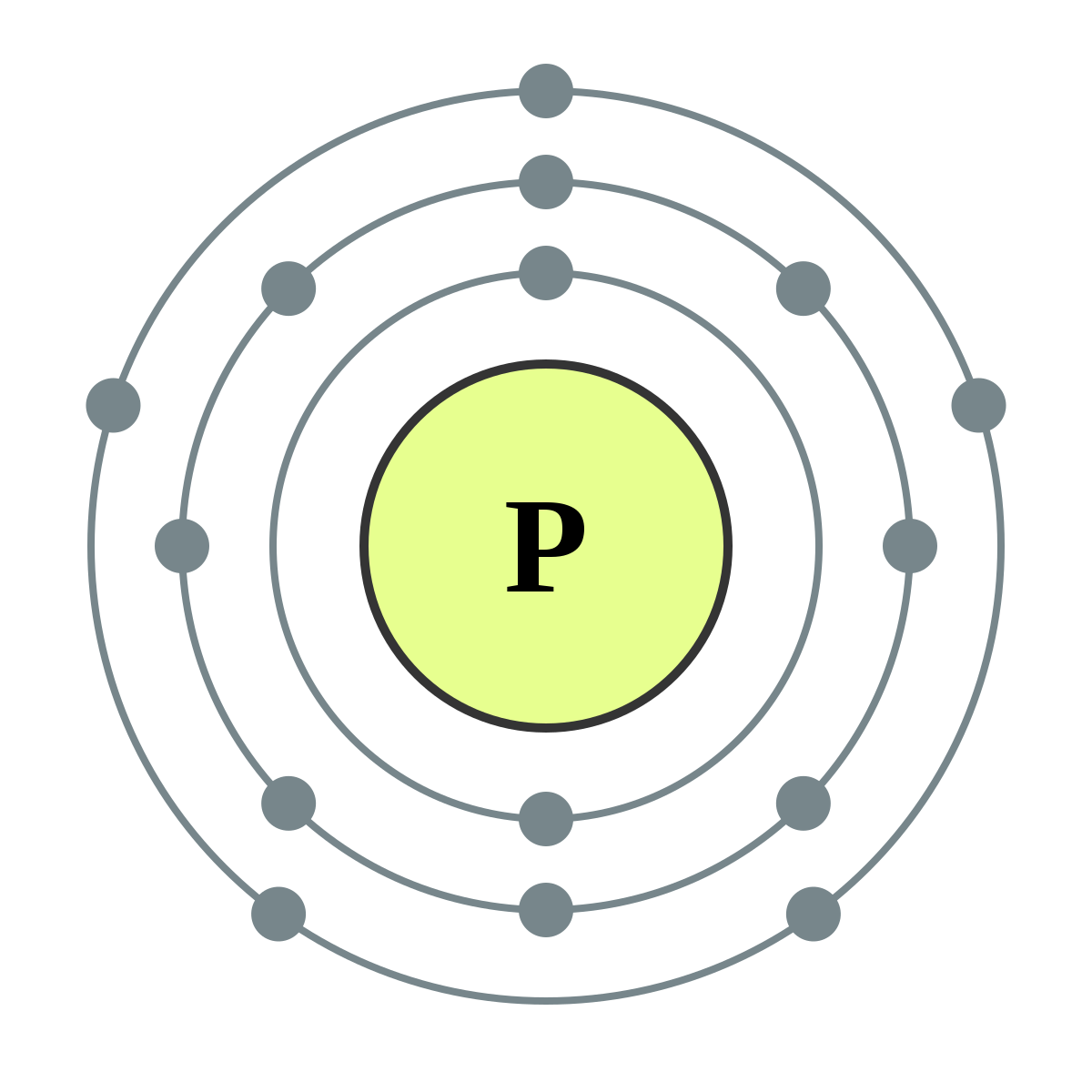
Fosfor:
7)
Cl = K: 2 L: 8: M: 7
O = K: 2 L: 6
Mg = K: 2 L: 8 M: 2
Li = K: 2 L: 1
H = K: 1
Ca = K: 2 L: 8 M: 8 N: 2
Kr = K: 2 L: 8 M: 18 N: 8
8) Avge valenselektroner, ta emot valenselektroner eller dela på valenselektroner.
9) Magnesiumatomen kan avge sina två valenselektroner till syreatomen. Båda atomerna kommer då få 8 elektroner i sitt yttersta skal.
10) Kloratomer har 7 valenselektroner. Genom att dela på 2 valenselektroner så kan båda få 8 elektroner i sitt yttersta skal.
11) Valenselektronerna har mest energi eftersom det är de elektronerna i atomen som sitter lösast och har lättast att röra på sig. De sitter lösast eftersom de sitter längst ut från atomkärnan och påverkas därför minst av kraften från atomkärnan (de positiva protonerna i atomkärnan attraherar de negativt laddade elektronerna).
12)
a) Nej. Vi kan enkelt urskilja de olika ämnena från varandra.
b) Nej. I en blandning av bensin och vatten så bildas två olika lager.
c) Ja. Natriumkloriden (vanligt salt) blandar sig fullständigt med vattnet och vi kan inte urskilja dem från varandra.
d) Ja. Luft är en homogen blandning av kvävgas, syrgas, koldioxid och lite andra ämnen. När vi tittar på luft så kan vi inte urskilja de olika ämnena från varandra.
e) Nej. Socker är bara en typ av molekyl och alltså ingen blandning av olika molekyler!
13)
a) Kemisk förening
b) Grundämne
c) Kemisk förening
d) Kemisk förening
e) Kemisk förening
f) Grundämne
14) Fast, flytande, gas. Höja eller sänka temperaturen.
15)
De har redan ädelgasstruktur, vilket innebär att de har 8 elektroner i sitt yttersta skal (helium har 2 valenselektroner eftersom helium bara har 1 skal och i det skalet får det bara plats 2 elektroner). 8 valenselektroner räknas som ett stabilt tillstånd (energifattigt tillstånd). Det yttersta skalet är redan ”fullt” och därför finns det ingen anledning att reagera med andra ämnen.
Att skalet är fullt är dock en sanning med modifikation. Vissa atomer får egentligen plats med fler än 8 valenselektroner men då måste de extra valenselektronerna fyllas på i s.k. underskal/orbitaler som ligger långt ut från atomkärnan. Det innebär att de extra valenselektronerna sitter väldigt löst/mycket energi (eftersom de sitter långt från atomkärnan) och lossnar därför väldigt enkelt.
Atomen blir väldigt reaktiv om elektronerna placeras i dessa underskal/orbitaler. Genom att bara fylla det yttre skalet med 8 elektroner (och därmed undvika de energirikaste underskalen/ orbitalerna i det yttre skalet) så får vi en stabilare, energifattigare och mindre reaktiv atom.
16) Metallglans, avger valenselektroner relativt lätt, leder ström, formbara.